近日,山东大学齐鲁医院络病理论创新转化全国重点实验室在心血管疾病基础研究中取得一系列新进展,在Nature旗下国际权威期刊Signal Transduction and Targeted Therapy(中科院一区,最新影响因子39.3)、国际权威期刊Advanced science(中科院一区,最新影响因子15.1)、Science子刊Science Advances(中科院一区,最新影响因子13.6)发表系列研究论文,受到国际学术界的高度关注。
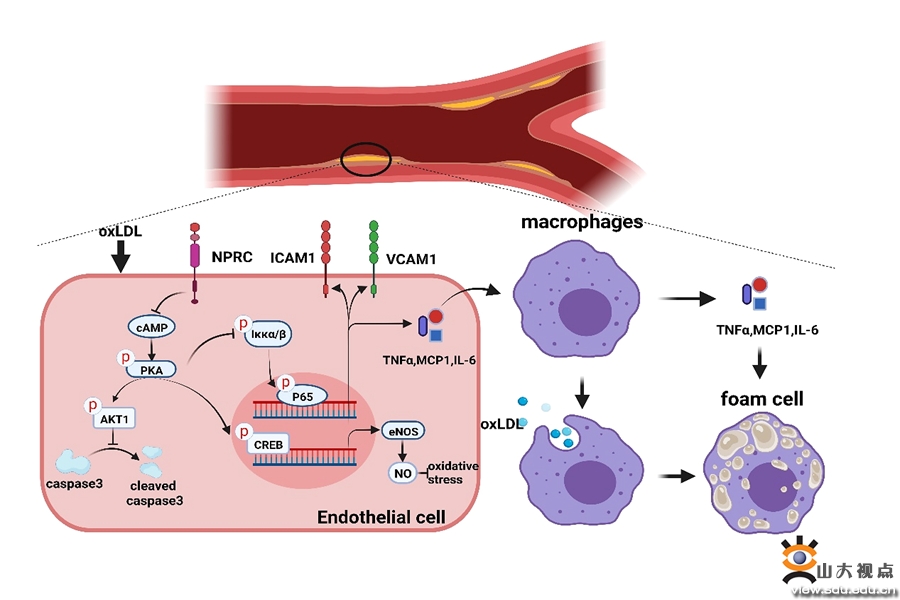
动脉粥样硬化(AS)引起的心血管疾病已成为全球人类死亡的主要原因,每年导致约1760万人死亡。为了发现中国汉族人群的冠心病易感基因,张运院士和张澄教授曾分别领导了两期国家863重大研究计划,进行了全国多中心冠心病全基因组关联研究,在3363例冠心病患者和3148例对照人群中,发现利钠肽受体C(NPRC)基因的6个单核苷酸多态性(SNP)位点与冠心病发病有显著性关联,调整传统的冠心病危险因素后这些关联依然存在,表明NPRC基因的SNP显著增加了中国汉族人群冠心病的易感性。然而,NPRC基因多态性与冠心病关联的分子机制不明。近年来,张运院士和张澄教授领导的课题组发现,利钠肽受体C (NPRC) 在AS小鼠模型(高脂喂养的ApoE-/-小鼠)病变中的表达显著增加。为了阐明NPRC在AS发病中的作用,课题组制备了小鼠NPRC全身基因敲除(ApoE-/-NPRC-/-)小鼠和内皮细胞条件性敲除(ApoE-/-NPRCecKO)小鼠模型,发现NPRC缺失均可显著减轻ApoE小鼠AS病变并增加斑块的稳定性。继之,课题组发现,NPRC缺失可通过上调cAMP/PKA/AKT1通路和下调NF-κB通路减轻氧化应激、炎症和内皮细胞凋亡,并增加eNOS的表达。最后,课题组通过注射AAV9构建了血管内皮细胞过表达NPRC的小鼠模型,发现血管内皮中NPRC的过表达扭转了上述趋势,加重了AS病变,降低了斑块稳定性。同时,NPRC过表达抑制了AKT1磷酸化、上调NF-κB通路进而促进血管炎症反应和细胞凋亡。综上,课题组发现NPRC缺失可通过上调cAMP/PKA/AKT1通路、下调NF-κB通路和增加eNOS表达减轻氧化应激、炎症和内皮细胞凋亡,最终改善AS病变。因此,进一步研发NPRC的阻滞剂或抗体可能为预防和治疗AS提供新的策略。该研究近日发表于Signal Transduction and Targeted Therapy,山东大学齐鲁医院心内科博士、中国医科大学附属盛京医院心内科博士后成程,山东大学齐鲁医院心内科博士后张杰和中国医科大学附属盛京医院心内科李晓东教授为论文的共同第一作者。张澄教授、张运院士和杨建民教授为论文的通讯作者,山东大学齐鲁医院为论文的第一和通讯作者单位。
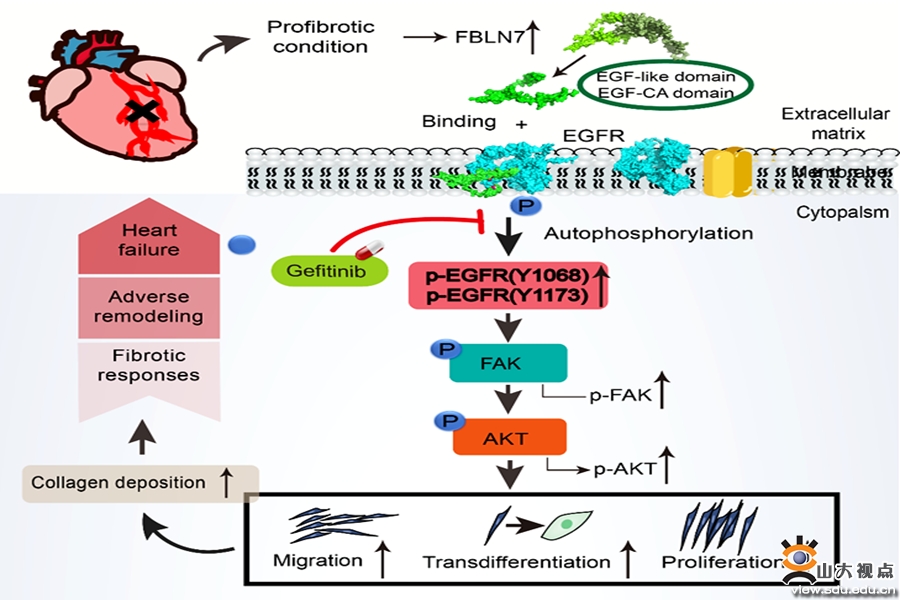
心肌纤维化是多种心脏病并发心力衰竭的共同病理过程,是导致不良临床事件的重要原因,其中成纤维细胞的过度激活在心肌纤维化的进展中起着重要作用。Fibulin家族是一类细胞外基质蛋白,其中部分成员参与调节心肌缺血再灌注损伤、心肌肥厚、血管重构等多种病理改变。Fibulin 7(FBLN7)是该家族中新发现的一个粘附蛋白,在肾小管钙化、肿瘤转移、血管新生等病理生理过程中发挥重要作用,但与心肌纤维化的关系尚不明了。为了探索FBLN7在心肌纤维化中的可能作用,卜培莉教授团队首先分析了肥厚型心肌病和扩张型心肌病患者心肌组织的转录组学数据,发现与正常对照者相比,FBLN7的mRNA水平显著上调。为了验证这一发现,研究人员构建了小鼠的心肌梗死模型,发现与假手术组相比,FBLN7的mRNA和蛋白表达在纤维化的心肌组织中显著升高。继之,课题组构建了Fbln7基因缺失(Fbln7‒/‒)小鼠,并在Fbln7‒/‒小鼠和同窝对照Fbln7+/+小鼠中构建了心肌梗死模型和假手术模型,发现Fbln7‒/‒心肌梗死小鼠的左室扩张、左室收缩功能降低和心肌纤维化程度都较Fbln7+/+心肌梗死小鼠明显减轻。为了进一步验证FBLN7在心肌纤维化中的作用,课题组构建了FBLN7过表达(AAV-FBLN7)小鼠和对照(AAV-NC)小鼠,并在这些小鼠中构建心肌梗死模型和假手术模型。结果表明,FBLN7过表达可进一步加重心肌梗死小鼠的左室扩张、左室收缩功能降低和心肌纤维化。免疫荧光共定位发现FBLN7与肌成纤维细胞共定位。课题组采用TGF-β1和Ang II刺激小鼠的心脏成纤维细胞,发现FBLN7可促进TGF-β1/Ang II诱导的成纤维细胞增殖、迁移和肌成纤维细胞转分化。其后,课题组研究了FBLN7调控成纤维细胞激活的机制,发现FBLN7通过与FAK的上游分子EGFR结合,促进EGFR在Y1068和Y1173位点的自磷酸化,进而促进FAK/AKT信号活化和成纤维细胞激活。此外,课题组证明,FBLN7通过其EGF-like和EGF-CA结构域与EGFR结合。综上,课题组发现FBLN7在成纤维细胞激活和心肌纤维化中起着重要作用。FBLN7通过促进EGFR的酪氨酸激酶活性,上调FAK/AKT信号通路,促进成纤维细胞激活和心肌纤维化。该研究揭示了心肌纤维化的发病新机制,为心肌纤维化的治疗提供了新靶点。该研究发表于国际权威期刊Advanced science,山东大学齐鲁医院心内科博士研究生郑雪慧是论文的第一作者,卜培莉教授为论文的通讯作者。山东大学齐鲁医院为论文的第一和通讯作者单位。
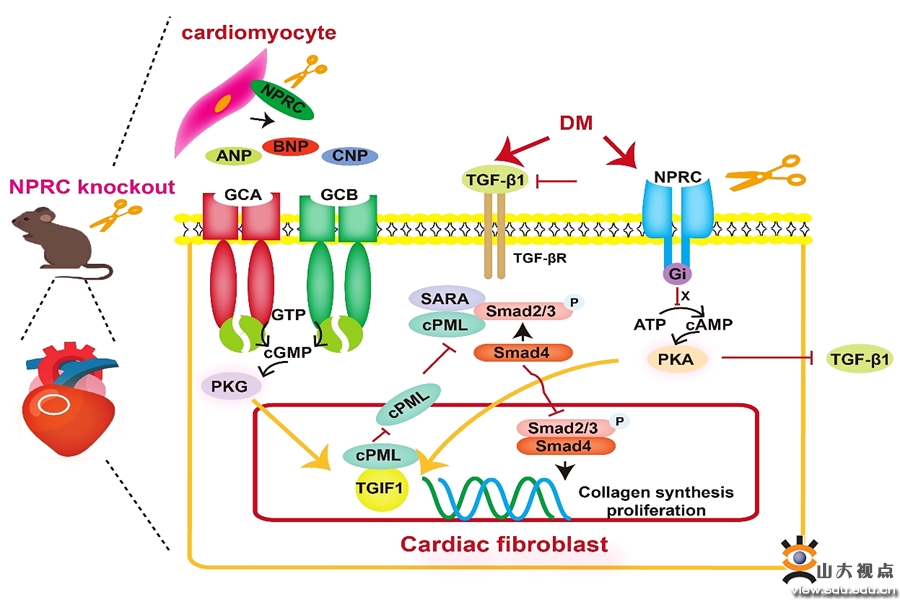
糖尿病性心肌病(DCM)是由糖尿病引发的以左室舒张和收缩功能障碍为特征的疾病,病理学改变包括心肌纤维化、心肌肥厚和心肌细胞凋亡等,其中心肌纤维化是DCM 的主要特征。然而,目前仍缺乏具有循证医学证据的改善糖尿病DCM的治疗手段。利钠肽家族(NPs)包括心房利钠肽(ANP)、脑利钠肽(BNP)、C型利钠肽(CNP)以及它们的3种受体GCA、GCB和NPRC研究发现,NPs可结合于GCA和GCB,通过其胞内段偶联的鸟苷酸环化酶(GC),激活细胞内的cGMP/PKG信号通路,发挥利尿、利钠、舒张血管、降低血压、改善病理性心室重构和心肌纤维化等心血管保护作用。与GCA和GCB不同,NPRC的胞内段未偶联GC,但含有抑制性鸟苷酸调节蛋白(Gi)的激动序列,可激活Gi,抑制cAMP/PKA信号通路。此外,NPRC通过内化和降解NPs,从局部环境或血液循环中清除NPs,维持其动态平衡,因此也被称为“清除受体”。研究发现,心脏中NPRC的分布密度明显高于其他两种受体,但迄今为止,尚无NPRC在DCM中的作用及机制的研究报道。张澄教授和张运院士领导的课题组发现,DCM小鼠和无明显冠脉狭窄的糖尿病心衰患者的心肌组织以及高糖(HG)刺激的心肌成纤维细胞中,NPRC的表达水平较相应对照组明显升高。为了明确NPRC在DCM发生和发展中的作用,课题组构建了NPRC基因敲除小鼠(NPRC-/-),并在NPRC-/-和同窝对照WT(NPRC+/+)小鼠中构建DCM模型。结果显示,NPRC基因敲除减轻了糖尿病小鼠的心肌间质和管周纤维化及胶原沉积,抑制了DCM心肌纤维化经典通路TGF-β1/Smad通路的激活,改善了糖尿病小鼠的左室重构及左室收缩和舒张功能。在体外实验中,课题组发现NPRC敲减可抑制心肌成纤维细胞的胶原合成和增殖及TGF-β1/Smad通路的激活。同时,心肌细胞NPRC敲减也可抑制心肌成纤维细胞的胶原合成和增殖及TGF-β1/Smad通路的激活,提示细胞间通讯的存在。为了深入研究NPRC基因干预调控心肌成纤维细胞功能的具体机制,课题组进行了转录组测序,并筛选出关键分子TGIF1。NPRC基因干预通过上调心肌成纤维细胞的TGIF1表达水平,阻止Smad2/3磷酸化的关键蛋白cPML由细胞核向细胞质的转移,从而减少了Smad2/3的磷酸化,导致心肌成纤维细胞的胶原合成和增殖受到抑制。其后,课题组对NPRC影响的胞内信号通路和胞外NPs水平进行了检测,发现NPRC敲除后,细胞内cAMP/PKA信号通路激活。同时,由于细胞外NPs清除减少,增加的NPs分别以自分泌和旁分泌的方式作用于心肌成纤维细胞,激活了细胞内cGMP/PKG信号通路。cAMP/PKA信号通路的激活可通过降低TGF-β1和上调TGIF1的表达水平协同抑制TGF-β1/Smad通路,而cGMP/PKG信号通路的激活则主要通过上调TGIF1的表达水平而抑制TGF-β1/Smad通路。综上,该研究发现DCM状态下心脏NPRC表达水平显著升高,NPRC基因敲除可减轻DCM小鼠的心肌纤维化,改善左室病理性重构和心功能,延缓DCM的进展,其分子机制为:NPRC基因敲除可激活cAMP/PKA和cGMP/PKG通路,上调细胞内TGIF1的表达,降低TGF-β1的水平,抑制TGF-β1/Smad通路的激活,从而抑制心肌成纤维细胞的胶原合成和增殖。上述发现为DCM的干预提供了新的靶点。该研究发表于国际权威期刊Science Advances,山东大学齐鲁医院心内科博士后孟霖霖是论文的第一作者,山东大学齐鲁医院心内科张澄教授和张运院士为论文的共同通讯作者,山东大学齐鲁医院为论文的第一和通讯作者单位。
原文链接:
https://www.nature.com/articles/s41392-023-01560-y
https://pubmed.ncbi.nlm.nih.gov/37344348/
https://pubmed.ncbi.nlm.nih.gov/37531438/