近日,山东大学齐鲁医院神经外科李刚教授、郭兴副教授团队在国际杂志Theranostics发表了题为“SPI1-mediated MIR222HG transcription promotes proneural-to-mesenchymal transition of glioma stem cells and immunosuppressive polarization of macrophages” (中科院一区,IF:11.6)的研究成果,首次揭示了宿主基因MIR222HG促进胶质母细胞瘤放疗耐受及免疫微环境抑制的新机制。李刚教授、郭兴副教授为论文共同通讯作者,神经外科硕士研究生樊扬、高梓杰、徐建业为论文共同第一作者,山东大学齐鲁医院是第一作者和通讯作者单位。
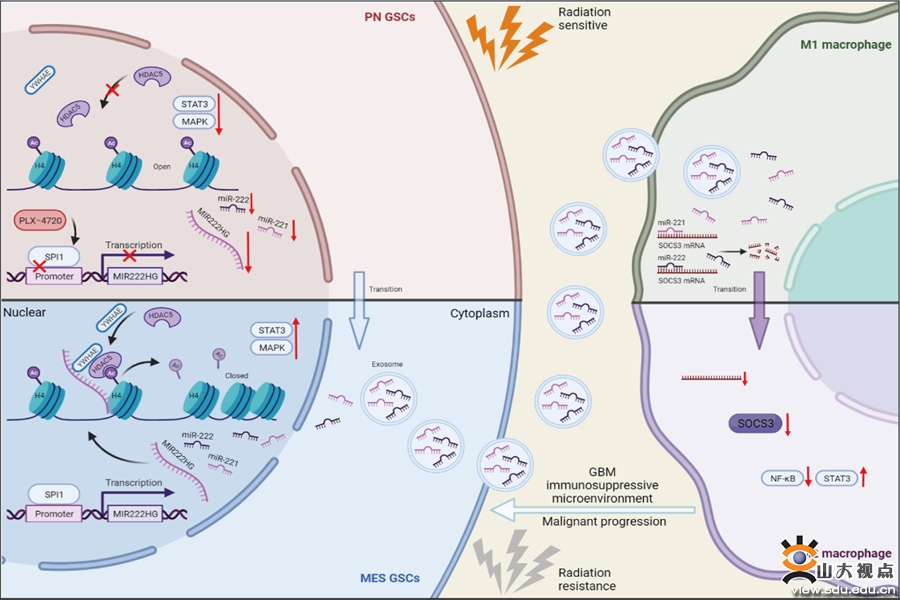
胶质母细胞瘤(Glioblastoma,GBM)是中枢神经系统最常见的恶性肿瘤,预后极差,即使接受规范的手术、术后放化疗等综合治疗,其中位生存期也不超过15个月。GBM难以根治的主要原因不仅是肿瘤难以切除干净,还与肿瘤的放疗耐受和免疫抑制性微环境密切相关。放射治疗一直是GBM治疗的主要手段,而驱动GBM放疗耐受的确切分子机制尚不清楚,GBM内部细胞的异质性和可塑性被认为是驱动治疗抗性和肿瘤复发的关键因素。基于肿瘤基因表达谱的异质性研究发现GBM至少存在三种亚型,分别是前神经元型(Proneural, PN)、经典型(Classical, CL)和间充质型(Mesenchymal, MES)。相比预后较好、对放疗较为敏感的PN亚型,MES亚型的GBM病人表现出较差的预后和较强的放疗抵抗性。已有研究表明随着病情的进展和肿瘤的复发,GBM表型会发生由PN型向MES型转化(Proneural-Mesenchymal Transition,PMT)的过程, PMT也被认为是肿瘤获得多重治疗耐受性和复发的标志。此外,MES型的GBM细胞会诱导微环境中的免疫细胞发生免疫功能抑制,进一步促进肿瘤恶性进展。
本研究首次证实宿主基因MIR222HG的转录本MIR222HG-201在MES型胶质瘤干细胞中高表达,并证实MIR222HG-201能促进胶质瘤干细胞从PN型向MES型转化进而产生放疗耐受性,此外与MIR222HG-201共转录的miR221和miR222可从胶质瘤干细胞中通过外泌体作用于巨噬细胞,引起巨噬细胞的免疫抑制。在发生机制方面,研究者发现MIR222HG-201可通过锚定组蛋白H4招募YWHAE/HDAC5复合体引起H4的去乙酰化,进而通过激活MAPK和STAT3信号通路促进胶质瘤干细胞的PMT,从而使胶质母细胞瘤获得更强的放疗耐受性。而共转录的miR221和miR222可通过外泌体作用于巨噬细胞引起SOCS3的降低,进而通过抑制NF-κB通路和激活STAT3通路引起巨噬细胞的免疫抑制。最后通过筛选发现PLX-4720这一靶向药物与宿主基因MIR222HG的转录因子SPI1表达量相关,PLX-4720与放疗联合应用可发挥更强的抗肿瘤效应;该研究成果为胶质母细胞瘤提供了新的放化疗联合干预策略。
李刚教授团队长期致力于脑胶质瘤免疫微环境调控、胶质瘤干细胞表型转化及肿瘤放化疗耐受等方面的研究,研究成果发表在Mol Cancer, Adv Science, Mol Therapy, Cancer Immunol Res, Oncogene等国际期刊上,本研究得到了国家自然科学基金及泰山学者攀登计划等项目的资助,同时得到山东省脑功能重构省级重点实验室、山东大学脑与类脑科学研究院等平台的支持。
相关链接:https://www.thno.org/v13p3310.htm#other_styles